Alüminyum Elementinin özellikleri Teknik bilgi ve tablolar
Alüminyum: izotop verileri
Doğal olarak oluşan izotoplar
Bu tablo, doğal olarak oluşan izotoplar , atomik kütleleri , doğal bollukları , nükleer spinleri ve manyetik momentleri hakkında bilgileri gösterir . Alüminyumun radyoizotopları (radyoaktif izotopları) için daha fazla veri (doğal olarak oluşanlar dahil) aşağıda listelenmiştir.
| İzotop |
Kütle / Da |
Doğal bolluk (atom %) |
Nükleer spin (I) |
Manyetik moment (μ/μ N ) |
| Al |
26.9815386 (8) |
100 |
5 / 2 |
3.641504 |
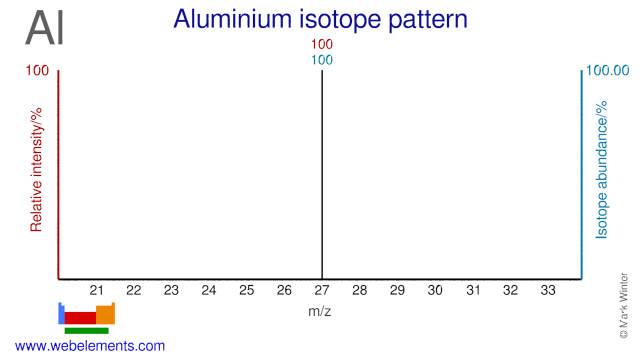
Alüminyum izotop bolluğu. Yukarıda, en yoğun iyon, bir kütle spektrometresinden elde edilen çıktıya en iyi karşılık geldiğinden, %100'e ayarlanmıştır. Bu, doğal olarak meydana gelen tüm izotoplar için %100 olan nispi yüzde izotop bolluğu ile karıştırılmamalıdır
Radyosotop verileri
Doğal olarak oluşan alüminyum izotopları için daha fazla veri yukarıda listelenmiştir. Bu tablo, alüminyumun bazı radyosotopları, kütleleri , yarı ömürleri , bozunma modları, nükleer dönüşleri ve nükleer manyetik momentleri hakkında bilgi verir.
| İzotop |
Kütle / Da |
Yarı ömür |
Çürüme modu |
Nükleer spin |
Nükleer manyetik moment |
| Al |
23.999941 |
2.07 sn |
EC + a ila 20 Ne; EC ila 24 Mg |
4 |
3.646 |
| Al |
24.990429 |
7.17 sn |
EC ila 25 mg |
5 / 2 |
|
| Al |
25.986892 |
710000 yıl |
EC ila 26 Mg |
5 |
|
| Al |
27.981910 |
2.25 m |
β - 28 Si'ye _ |
3 |
3.24 |
| Al |
28.980446 |
6,5 m |
β - 29 Si'ye _ |
5 / 2 |
|
| Al |
29.98296 |
3.68 sn |
β - 29 Si'ye _ |
3 |
|
Alüminyum: jeolojik bilgi
Çeşitli ortamlarda alüminyum bolluğu
Bu bolluk tablosunda değerler , hem ağırlık hem de atom sayısı açısından ppb (parça/milyar; 1 milyar = 10 9 ) birimlerinde verilmiştir . Bolluk değerlerinin kesin olarak belirlenmesi zordur, bu nedenle özellikle daha az yaygın olan elementler için tüm değerlere biraz dikkatle yaklaşılmalıdır. Herhangi bir elementin yerel konsantrasyonları burada verilenlerden farklı olabilir ve çeşitli literatür kaynaklarındaki daha az yaygın elementler için değerler önemli ölçüde farklılık gösterir.
Bir dizi farklı ortamda alüminyum bolluğu. Tanımlar, literatür kaynakları ve birçok farklı stilde görsel temsiller için konum sütunundaki bağlantıları kullanın (bunlardan biri aşağıda gösterilmiştir)
| Konum |
Ağırlıkça ppb |
Atomlar tarafından ppb |
| Evren |
50000 |
2000 |
| Güneş |
60000 |
3000 |
| Göktaşı (karbonlu) |
9300000 |
670000 |
| Kabuklu kayalar |
82000000 |
63000000 |
| Deniz suyu |
5 |
1.1 |
| Aktarım |
400 |
15 |
| İnsan |
900 |
210 |
Alüminyum: Fiziksel özellikler
Yoğunluk özellikleri
Katının yoğunluğu : 2700 kg m -3
Molar hacim : 10.00 cm 3
Elastik özellikler
Young modülü : 70 GPa
Sertlik modülü : 26 GPa
Toplu modül : 76 GPa
Poisson oranı : 0,35 (birim yok)
Sertlikler
Mineral sertliği : 2.75 (birim yok)
Brinell sertliği : 245 MN m -2
Elektriksel özellikler
Elektrik direnci : 2,7 × 10 8 Ω m; veya mΩ cm
Isı ve iletim
Termal iletkenlik : 235 W m -1 K -1
Doğrusal termal genleşme katsayısı : 23,1 × 10 6 K 1
Optik özellikler
Vickers sertliği : 167 MN m -2
Yansıtma : %71
Kırılma indisi : (veri yok) (birim yok)
Akustik özellikler
Sesin hızı : 5100 m s -1
Alüminyum: elementlerin reaksiyonları
Alüminyumun hava ile reaksiyonu
Alüminyum gümüşi beyaz bir metaldir. Alüminyum metalin yüzeyi, metalin hava saldırılarına karşı korunmasına yardımcı olan ince bir oksit tabakası ile kaplanmıştır. Bu nedenle, normalde aulumium metali hava ile reaksiyona girmez. Oksit tabakası zarar görürse, alüminyum metal saldırıya maruz kalır. Alüminyum, trioksit alumnium ( III) oksit, Al203'ü oluşturmak için parlak beyaz bir alevle oksijende yanacaktır .
4Al(s) + 3O 2 (l) → 2Al 2 O 3 (s)
Alüminyumun su ile reaksiyonu
Alüminyum gümüşi beyaz bir metaldir. Alüminyum metalin yüzeyi, metalin hava saldırılarına karşı korunmasına yardımcı olan ince bir oksit tabakası ile kaplanmıştır. Bu nedenle, normalde aulumium metali hava ile reaksiyona girmez. Oksit tabakası zarar görürse, alüminyum metal su ile bile saldırıya maruz kalır.
Alüminyumun halojenlerle reaksiyonu
Alüminyum metal, alüminyum halojenürler oluşturmak için tüm halojenlerle kuvvetli bir şekilde reaksiyona girer. Böylece, sırasıyla alüminyum(III) klorür, AlCl3, alüminyum(III) bromür, AlBr3 ve alüminyum(III) iyodür, Al'i oluşturmak üzere klor , Cl 2 , brom, I 2 ve iyodin, I 2 ile reaksiyona girer. 3 .
2Al(s) + 3Cl 2 (l) → 2AlCl 3 (s)
2Al(s) + 3Br 2 (l) → Al 2 Br 6 (s)
2Al(s) + 3I 2 (l) → Al 2 I 6 (s)
Alüminyumun asitlerle reaksiyonu
Alüminyum metal, sulandırılmış Al ( III) iyonunu hidrojen gazı H2 ile birlikte içeren çözeltiler oluşturmak için seyreltik sülfürik asit içinde kolayca çözünür . Seyreltik hidroklorik asit ile karşılık gelen reaksiyonlar ayrıca sulu Al(III) iyonunu verir. Konsantre nitrik asit alüminyum metali pasifleştirir.
2Al(s) + 3H 2 SO 4 (sulu) → 2Al 3+ (sulu) + 2SO 4 2- (sulu) + 3H 2 (g)
2Al(s) + 6HCl(sulu) → 2Al 3+ (sulu) + 6Cl - (sulu) + 3H 2 (g)
Alüminyumun bazlarla reaksiyonu
Alüminyum, sodyum hidroksit içinde hidrojen gazı, H 2 'nin oluşumu ve [Al(OH) 4 ] - tipi alüminatların oluşumu ile çözülür .
2Al(s) + 2NaOH(sulu) + 6H20 → 2Na + (sulu) + 2 [Al(OH) 4 ] - + 3H2 (g)
Alüminyum: kristal yapılar
- Uzay grubu: Fm-3m
- Uzay grubu numarası: 225
- Yapı: ccp (kübik kapalı paket)
- Hücre parametreleri:
- bir : 404,95 pm
- b : 404,95 pm
- c : 404,95 pm
- α: 90.000°
- β: 90.000°
- y: 90.000°
Alüminyumun yapısını inceleyebilirsiniz:
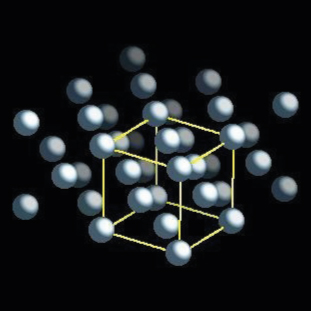
Alüminyum kristal yapı görüntüsü (top ve çubuk stili).

Alüminyum kristal yapı görüntüsü (boşluk doldurma stili).
Alüminyum: biyolojik bilgi
Alüminyum, süksinik dehidrojenaz ve δ-aminolevulinat dehidraz (porfirin sentezinde yer alır) gibi enzimlerin faaliyetinde yer alabilir. Alüminyum bileşikleri çoğu bitki için toksiktir ve memeliler için biraz toksiktir. Alüminyum, Alzheimer hastalığına (yaşlılık demansı) bağlanmış.
İnsanlardaki seviyeler
İnsanlarda elementlerin bolluğu .
- Ağırlıkça insan bolluğu: ağırlıkça 900 ppb
- Atomlara göre insan bolluğu : C = 1000000'e göre 210 atom
Tehlikeler ve Riskler
Alüminyum metal, toz haline getirildiğinde yangın tehlikesi oluşturur. Alüminyum bileşikleri çoğu bitki için zehirlidir ve memeliler için biraz zehirlidir. Alüminyum, Alzheimer hastalığına (yaşlılık bunama) bağlanmıştır. Alüminyum vücutta birikir.
Alüminyum: serbest atomların özellikleri
Alüminyum atomlarının 13 elektronu vardır ve kabuk yapısı 2.8.3'tür.
Temel durum gazlı nötr alüminyumun temel durum elektron konfigürasyonu [ Ne ]'dir. 3s 2 . 3p 1 ve terim sembolü 2 P 1 /2'dir .

Alüminyumun şematik elektronik konfigürasyonu.
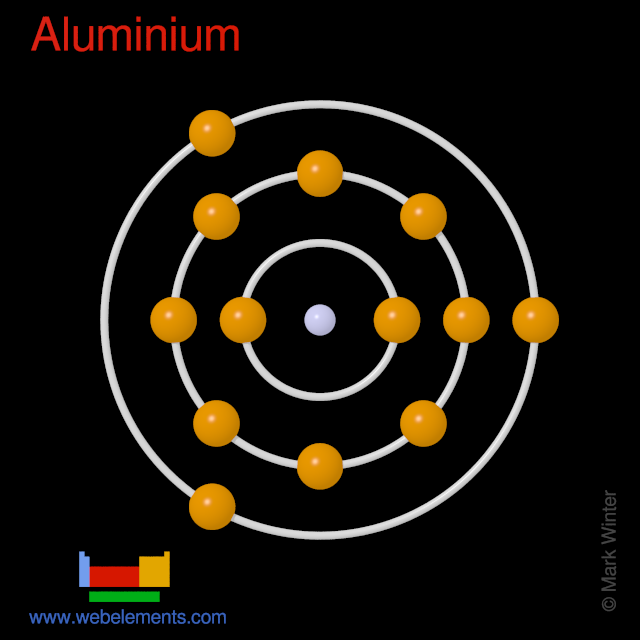
Alüminyumun Kossel kabuk yapısı
atomik spektrum
Alüminyumun atomik spektrumunun bir temsili.
İyonlaşma Enerjileri ve elektron ilgisi
Alüminyumun elektron ilgisi 42,5 kJ mol 1'dir . Alüminyumun iyonlaşma enerjileri aşağıda verilmiştir
Alüminyumun iyonlaşma enerjileri
| İyonlaşma enerjisi numarası |
Entalpi / kJ mol 1 |
| 1 inci |
577,54 |
| 2. |
1816.68 |
| 3 üncü |
2744,78 |
| 4. |
11577.50 |
| 5. |
14841.9 |
| 6. |
18379 |
| 7. |
23326 |
| 8. |
27464 |
| 9. |
31860 |
| 10. |
38464 |
| 11. |
42647 |
| 12. |
201266 (hesaplandı) |
| 13. |
222316 |
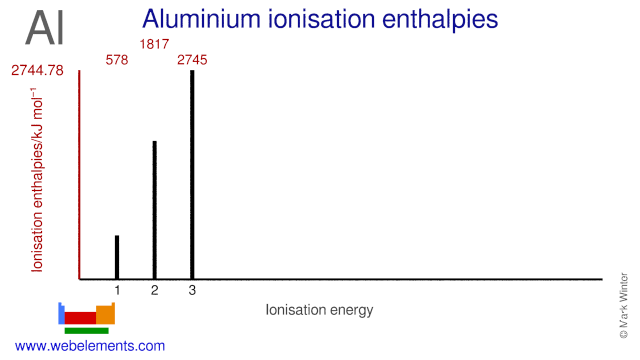
Alüminyumun iyonlaşma enerjileri.
Etkili Nükleer Yükler
Aşağıdakiler " Clementi-Raimondi " etkili nükleer yüklerdir, Z eff . Daha fazla ayrıntı ve çeşitli formatlardaki grafikler için köprüleri takip edin.
Alüminyum için etkili nükleer yükler
| 1s |
12.5910 |
| 2s |
8.21 |
| 3s |
4.12 |
| 4s |
(veri yok) |
| 2p |
8.96 |
| 3p |
4.07 |
| 3 boyutlu |
(veri yok) |
| 4p |
(veri yok) |
| 4d |
(veri yok) |
| 5s |
(veri yok) |
| 5p |
(veri yok) |
| 5d |
(veri yok) |
| 6s |
(veri yok) |
| 6p |
(veri yok) |
Elektron bağlama enerjileri
Alüminyum için elektron bağlama enerjileri. Elektron bağlama enerjilerinin tüm değerleri eV cinsinden verilmiştir. Bağlanma enerjileri, nadir gazlar ve H 2 , N 2 , O 2 , F 2 ve Cl 2 molekülleri için vakum seviyesine göre belirtilir; metaller için Fermi seviyesine göre; ve yarı iletkenler için değerlik bandının tepesine göre.
| Etiket |
Orbital |
eV [literatür referansı] |
| K |
1s |
1559 [1] |
| ben |
2s |
117.8 [2] |
| L II |
2p 1/2 |
72.9 [2] |
| L III |
2p 3/2 |
72.5 [2] |
Alüminyum: bileşikler bilgisi
Bu bölüm, halojenler (halojenürler olarak bilinir), oksijen (oksitler olarak bilinir), hidrojen (hidritler olarak bilinir) ve diğer bazı alüminyum bileşikleri içeren bazı ikili bileşikleri listeler. Her bileşik için alüminyum için resmi bir oksidasyon numarası verilir, ancak bu sayının kullanışlılığı özellikle p -blok elementleri için sınırlıdır. Bu oksidasyon numarasına dayalı olarak, bir elektronik konfigürasyon da verilmiştir, ancak daha egzotik bileşikler için bunu yalnızca bir kılavuz olarak görmeniz gerektiğini unutmayın.
Alüminyum bileşiklerinde (bilinen yerlerde), alüminyumun en yaygın oksidasyon sayıları şunlardır: 3 .
hidrürler
Hidrit terimi, M x Hy tipi bileşikleri belirtmek için kullanılır ve listelenen herhangi bir bileşiğin kimyasal olarak hidrit gibi davrandığını belirtmek zorunda değildir.
Alüminyum trihidrit : AlH 3
florürler
Alüminyum triflorür : AlF 3
klorürler
Dialuminyum heksaklorür : AlCl 3
bromürler
Dialuminyum heksabromit : [AlBr 3 ] 2
iyodürler
Dialuminyum heksaiyodür : [AlI 3 ] 2
oksitler
Alüminyum oksit (α) : Al 2 O 3
sülfürler
Dialuminyum trisülfit : Al 2 S 3
selenitler
Dialuminyum triselenid : Al 2 Se 3
Tellüridler
Dialuminyum tritellürid : Al 2 Te 3
nitrürler
Alüminyum nitrür : AlN
karboniller
hiçbiri listelenmedi
kompleksler
Alüminyum trinitrat nonahidrat : Al(NO 3 ) 3 .9H 2 O
Dialuminyum trisülfat oktadekahidrat : Al 2 (SO 4 ) 3 .18H 2 O
Heksaakualuminyum tribromür : [Al(OH 2 ) 6 ]Br 3
Heksaakualuminyum triklorür : [Al(OH 2 ) 6 ]Cl 3